蛋白質降解新機制:發現蛋白酶體辨識分枝型泛素鏈的關鍵結構
發布時間: 2025-10-16
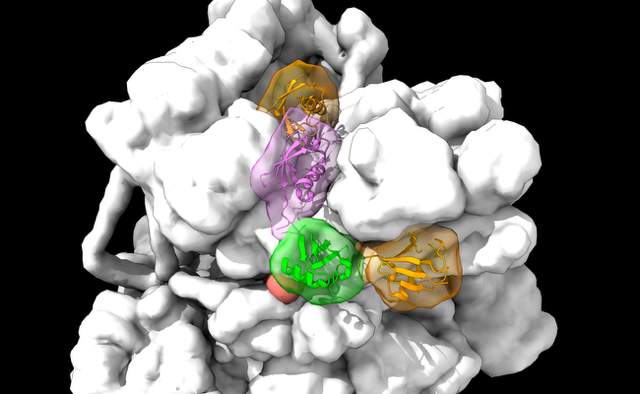
本院生物化學研究所徐尚德研究員領導的國際合作團隊,首度以冷凍電子顯微鏡解析出人類26S蛋白酶體與分枝型K11/K48泛素鏈結合時的高解析度結構,揭示蛋白酶體如何精準辨識需快速降解的蛋白質。研究團隊發現,蛋白酶體中RPN2次單元具有一個先前未知的K11泛素結合位點,與RPN8、RPN10及已知的K48結合區域RPT4/5等多個次單元結構域共同形成「多重辨識界面」。此結構能有效識別分枝型泛素鏈,進而啟動目標蛋白質的降解程序。這項發現揭開了細胞如何透過複雜的泛素訊號,以維持蛋白質穩態,為了解細胞品質控制提供關鍵的分子依據。
本研究之經費來自本院及國科會,並由本院低溫電子顯微鏡核心設施與蛋白體與蛋白修飾分析公用質譜儀設施提供關鍵技術支援。
第一作者卓彼得博士(Piotr Draczkowski)於2017至2020年間獲得本院博士後計畫支持,並於2021至2022年獲科技部(現國科會)延續資助。研究成果已於2025年10月15日發表於《自然通訊》(Nature Communications),並被編輯評選為亮點論文。









 首頁
首頁