【專欄】一個有故事的天然小分子——唾液酸
作者:李文山研究員(本院化學研究所)、林音秀博士 專案經理(本院生醫轉譯研究中心)

2001年回到本院化學研究所後,筆者開始漫長的小分子新藥研發,以及研究唾液酸 (Sialic Acid; Sia)奇妙之旅。唾液酸是神經胺酸 (Neuraminic Acid) 類衍生物的總稱,這種神經胺酸目前已知超過50種,如N-乙醯神經胺酸 (Neu5Ac)、N-乙醇酰神經氨酸 (Neu5Gc)、脫氨基神經氨酸(Kdn)以及其修飾衍生物,像是最簡單的甲基化衍生物或是不同位置的乙醯化和硫酸化的衍生物都屬於唾液酸1。人類的唾液(口水)含有少量的唾液酸 (Neu5Ac),但缺乏Neu5Gc。因此有時候大家會用唾液酸專指此類化合物中最重要的成員,Neu5Ac,如圖一,比起牛奶、蛋黃、尤其是燕窩,人類的口水中的唾液酸含量少了很多。
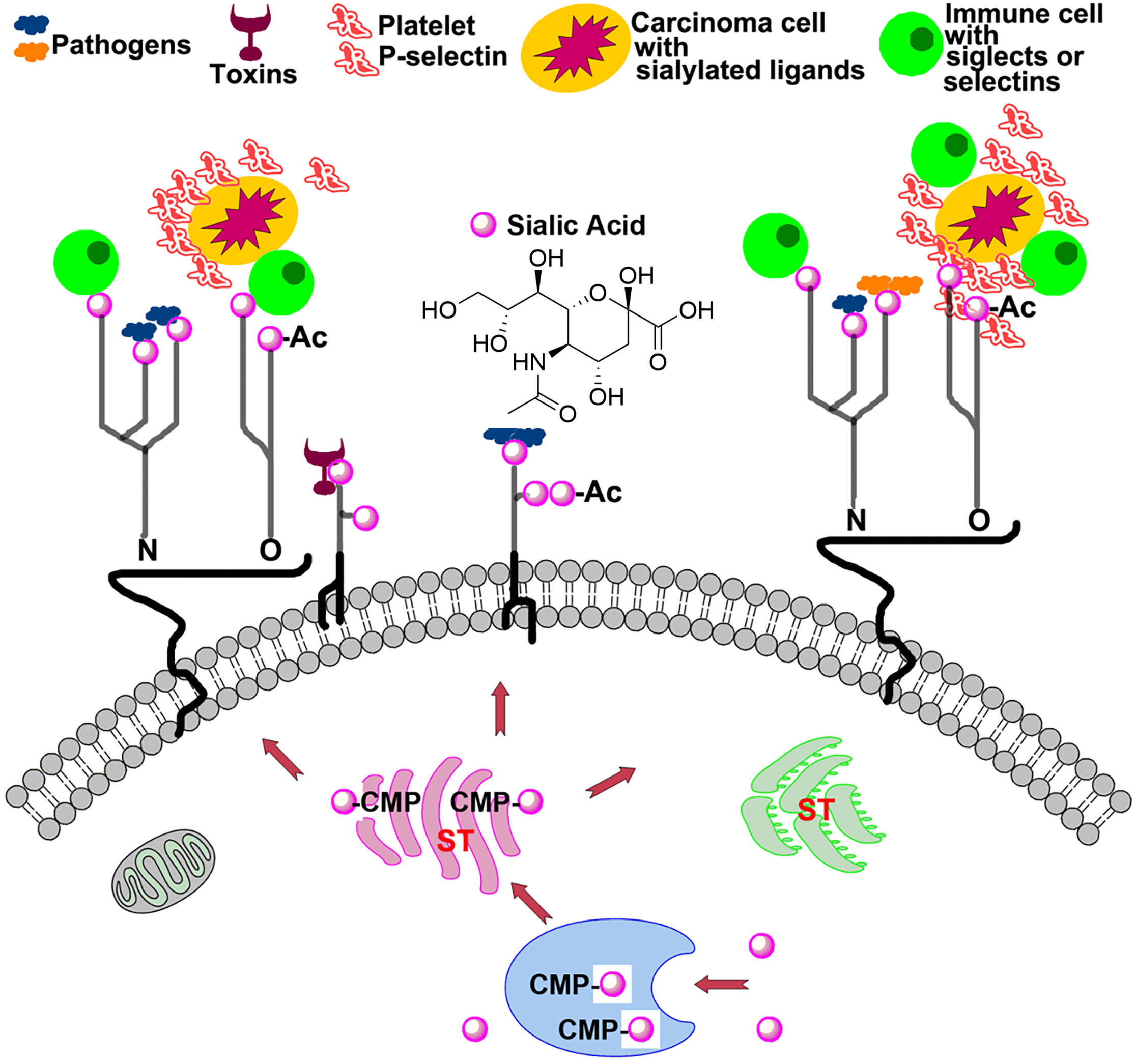
圖一:細胞中唾液酸代謝途徑及細胞表面唾液酸殘基其病理生物學交互作用的圖示。
這些帶有負電的九個碳的酸性糖,唾液酸,裝飾在所有脊椎動物及「高等」無脊椎動物的細胞表面及其分泌的蛋白質上,稱作唾液酸化(Sialylation),以此介導或調節各種正常甚至病理過程。在哺乳動物中,末端唾液酸化以單一形式存在實體或作為 N- 和 O- 連接的聚唾液酸 (PolySia) 鏈醣蛋白和醣脂的聚醣。唾液酸化可以透過不同連結的方式,如 α-2,3- 或 α-2,6-鍵與半乳糖 (Gal) 或聚醣的N-乙醯半乳糖胺 (GalNAc) 單元,或經由 α-2,8- 或 α-2,9-鍵結至其他唾液酸。經由這種修飾不僅提供了一層細胞的靜電斥力,也充當各種生物訊號傳導途徑的受體。鑑於其對細胞功能的多方面參與,調控唾液酸化已是一種有效的治療疾病的方式2
微生物學和傳染病
唾液酸化顯著影響病毒結合和複製機制。以流感病毒來說,流感病毒與唾液酸化的特定宿主細胞上的聚醣透過血凝素 (hemagglutinin) 產生相互作用,此過程促進膜融合和內吞作用,使病毒容易入侵。像家喻戶曉 H5N1「禽流感」病毒,這種在野生和家養鳥類中感染和傳播的流感病毒,優先識別鳥類聚醣鏈 α2-3 連接的唾液酸。人類對此類病毒的感染應具有相當的抵抗力,因為我們表現的是α2-6 連接的唾液酸3。
但若是病毒的血凝素(hemagglutinin)成分經過特定的突變,優先結合 α2-6 連接的唾液酸或是病毒從野鳥傳播到家禽,然後進入人類馴養的哺乳動物,例如豬,那麼禽流感「跳躍」直接傳播人類的情況也有其可能性。因為豬同時具有 α2-3- 和上皮細胞的 α2-6 連接唾液酸,禽流感病毒可以利用它充當「混合容器」,進而感染人類,我們實驗室最近的研究成果也間接證實了這樣的觀點。此外,許多病原體,像真菌、細菌和原生動物等微生物,也在其自身表面表達唾液酸,以降低免疫原性。
唾液酸化在腫瘤中扮演的角色
在大多數腫瘤細胞中觀察到高度唾液酸化且伴隨著唾液酸酶(sialidase)活性、唾液酸轉移酶(sialyltransferase)活性、或唾液酸蛋白(sialoproteins)的增加4。這種唾液酸化程度升高,增強腫瘤細胞的抗藥性並促進癌細胞增殖。更糟的是,人類整合素(integrins)的唾液酸化可以阻斷細胞凋亡訊號,防止腫瘤細胞死亡5。唾液酸化在不同癌症轉移過程中,如逃離原發部位、在血液中生存、淋巴轉移和附著到新的遠端部位,都扮演著關鍵的角色。
例如,表皮生長因子受體(EGFR)的α2-6-唾液酸化已被證明可以調節上皮間質癌細胞的轉變(EMT),影響細胞膜保留,調節整合素張力,並影響黏附和細胞運動。癌症患者預後不良通常與腫瘤相關碳水化合物抗原的唾液酸化息息相關,例如唾液酸Tn (Sialyl Tn)增加,可以增強癌症侵襲性。而利用這些反應機制,我們發展了唾液酸轉移酶(sialyltransferase)廣效型抑制劑及選擇性N-唾液酸化或O-唾液酸化唾液酸轉移酶(sialyltransferase)抑制劑,其中一個唾液酸轉移酶廣效型抑制劑,「石膽甘氨酸(Lithocholylglycine)」6,已在市面上販售,可應用於降低腫瘤轉移的研究。
惡性腫瘤表面的唾液酸聚醣增多會產生「抗原掩蔽」效應,顯著影響腫瘤免疫原性並能夠隱藏腫瘤相關抗原。腫瘤細胞表面的緻密唾液酸聚醣層產生空間和靜電屏障,有效遮蔽潛在的聚醣和蛋白質抗原決定位(epitope)以逃避免疫細胞認出。在腫瘤進展過程中,唾液酸結合抗原可以發揮作用作為干擾巨噬細胞功能的「請別吃我」訊號,這些訊號也可以傳遞給NK細胞和T細胞,抑制其活性。
唾液酸是大腦的甜蜜小分子
母乳提供發育中的大腦最佳營養來源,母乳哺育可顯著提高嬰兒認知能力的發育。這些好處歸功於母乳寡糖(human milk oligosaccharides; HMOS)和唾液酸。唾液酸化的 HMOS 成為嬰兒重要的外源性唾液酸來源,唾液酸是正常發育所必需的關鍵分子,如形成神經節苷脂(gangliosides),因此對嬰兒大腦發育功能至關重要。所以大腦生長和成熟與唾液酸的糖脂/蛋白含量增加有關,而先天性發育遲緩和衰老也與其含量下降息息相關。多項研究顯示,人類在懷孕期間唾液酸濃度會增加。此外,母乳哺育比配方奶餵養提供更高的唾液酸營養。
唾液酸不僅對中樞神經系統發育有正面影響,最近的研究指出,唾液酸依賴性與神經退化性疾病的病理學密切相關: 如阿茲海默症 (AD)、帕金森氏症 (PD) 和亨廷頓氏症 (HD)。 Fukami 等人進行的一項研究顯示含唾液酸的神經節苷(gangliosides,如GM1和GD1a) 代謝改變可能與 AD 的發病機制有關7。此外,Lenzi 等人進行了一項隨機、雙盲、安慰劑對照試驗,納入了 792 名患者。結果顯示GM1的使用劑量是安全的; 與接受安慰劑治療的患者相比,接受 GM1 治療的患者神經狀態顯著改善8。這種正面的報導也出現在亨廷頓氏症 (HD)上。
而相關研究也證實Sia/PolySia 血清濃度與精神分裂症(Schizophrenia)、自閉症譜系障礙 (Autism spectrum disorder) 、Salla 疾病、中度嚴重 Salla 病及嬰兒遊離唾液酸貯積症(ISSD)有密切關係。但臨床實驗結果並不支持直接口服Neu5Ac來治療N-乙醯神經氨酸合成酶(NANS) 缺乏症,這凸顯找到潛在治療途徑的急迫性。直到目前唾液酸潛在的神經保護機制尚未了解,且唾液酸治療某些神經退化性疾病的證據有限; 目前研究中沒有明確的證據顯示口服唾液酸具有益處。但是,神經退化性疾病與大腦唾液酸水平之間存在些關聯是非常明確的。
人類進化並沒有兩全其美
猴子能合成唾液酸變異體N-乙醇酰神經氨酸(Neu5Gc),而人類表現 Neu5Ac,但缺乏Neu5Gc。人類祖先為了避免瘧原蟲感染死亡或其他原因而造成胞苷單磷酸Neu5Ac羥化酶(CMAH)的突變,從此人類不能再用CMAH將N-乙醯神經氨酸 (Neu5Ac) 轉化為 Neu5Gc。我們祖先在兩三百萬年前失去這單一基因,這可能導致所有人類罹患心血管疾病的風險增加,同時也為吃紅肉的人類帶來了進一步的風險,因為人類所消耗的 Neu5Gc(來自紅色肉)經由代謝轉化為“異種自身抗原”內源性糖綴合物,與循環抗-Neu5Gc「異種自體抗體」接觸會加劇慢性發炎9。實驗證實心臟病在黑猩猩中極為罕見。更多數據表明人類進化過程中CMAH的喪失可能會導致人類增加心血管疾病(CVD)風險。
核酸藥物:從COVID-19疫苗的突破到未來醫療的藍圖
由於mRNA-LNP技術的發展,讓許多疾病的治療方法獲得機會。如Salla 疾病、中度嚴重 Salla 病及嬰兒遊離唾液酸貯積症 (ISSD)就可以利用此一技術。而mRNA-LNP技術需要使用可電離脂質 (ionizable lipid),中央研究院生醫轉譯研究中心已成功發展出來新的脂質10,經由專利技轉,已有五種可電離脂質在市面上販售,提供學術界與產業界研究和臨床使用。以下就為讀者介紹本院生醫轉譯研究中心的核酸先導設施。
COVID-19疫情的爆發加速了核酸藥物的研究與應用,尤其是Pfizer-BioNTech和Moderna利用mRNA技術結合脂質納米顆粒(LNP)成功開發的COVID-19疫苗,展現了其在減緩病毒傳播、降低重症及死亡率方面的卓越效果。核酸藥物以DNA或RNA分子為基礎,能通過精準調控基因表達與蛋白質合成,實現預防與治療疾病的目標。mRNA疫苗是核酸藥物的一種,它攜帶人工設計的mRNA序列,引導人體細胞製造病毒抗原,從而激發免疫系統產生特異性防禦反應。LNP技術在這一過程中發揮關鍵作用,通過包裹和保護脆弱的mRNA分子,使其免受體內酶降解,同時幫助其順利進入細胞內發揮作用(圖二)。

圖二:mRNA-LNP 於細胞內作用之示意圖。
這一技術突破顯著提升了疫苗的穩定性和效能。核酸藥物的成功應用不僅限於傳染病疫苗,還展現在癌症治療的潛力,例如設計個人化mRNA疫苗來教導免疫系統識別並攻擊腫瘤細胞。此外,核酸藥物還可用於糾正基因突變、治療基因缺陷性疾病、自身免疫性疾病及其他慢性病,開創全新的治療途徑。隨著技術持續進步與臨床試驗不斷推進,核酸藥物有望成為未來醫療的重要支柱,帶來更高效、更安全的創新治療方案,進一步改變醫療技術的格局。COVID-19疫苗的成功僅是開端,核酸藥物將在更多領域發揮關鍵作用,為醫學發展帶來全新契機,並為人類健康開啟新的篇章。
為支持核酸藥物的開發,生醫轉譯中心自2020年底開始,著手規劃建立以核酸藥物生產及品質分析為核心的專業設施,旨在提供完整的研發及生產解決方案。歷經三年的密集籌備與技術開發,於2023年成功完成小規模生產製程開發、產品品質分析方法建置,以及符合國際標準的GMP試驗工廠 (GMP pilot plant) 建設。核酸先導設施於2023年9月正式進入試營運階段,開始提供服務。核酸先導設施專注於滿足學術界與產業界對核酸藥物日益增長的需求,包括mRNA、siRNA、ASO等核酸製劑的生產技術開發,以及相關的品質檢測與驗證服務。未來,該設施將致力於推動核酸藥物技術的創新與應用,打造跨領域合作的平台,並加速核酸藥物產品從實驗室走向市場的進程。
1. Ajit Varki, Sialic Acids in Human Health and Disease, Trends Mol. Med. 2008, 14, 351.
2. Ser John Lynon P. Perez, Chih-Wei Fu and Wen-Shan Li, Sialyltransferase Inhibitors for the Treatment of Cancer Metastasis: Current Challenges and Future Perspectives, Molecules 2021, 26, 5673.
3. Wengen Zhu, Yue Zhou, Linjuan Guo, Shenghui Feng, Biological Function of Sialic Acid and Sialylation in Human Health and Disease, Cell Death. Discov. 2024, 10, 415.
4. Jia-Yang Chen, Yen-An Tang, Sin-Ming Huang, Hsueh-Fen Juan, Li-Wha Wu, Ying-Chieh Sun, Szu-Chi Wang, Kuan-Wei Wu, Gopula Balraj, Tzu-Ting Chang, Wen-Shan Li, Hung-Chi Cheng, and Yi-Ching Wang, A Novel Sialyltransferase Inhibitor Suppresses FAK/Paxillin Signaling and Cancer Angiogenesis and Metastasis Pathways, Cancer Res., 2011, 71, 473.
5. Chih-Wei Fu, Han-En Tsai, Wei-Sheng Chen, Tzu-Ting Chang, Chia-Ling Chen, Pei-Wen Hsiao, and Wen-Shan Li, Sialyltransferase Inhibitors Suppress Breast Cancer Metastasis, J. Med. Chem. 2021, 64, 527.
6. Kai-Hsuan Chang, Lenselot Lee, Jessica Chen, Wen-Shan Li, Lithocholic Acid Analogues, New and Potent a-2,3-Sialyltransferase Inhibitors, Chem Comm. 2006, 629.
7. Yuki Fukami, Toshio Ariga, Mitsunori Yamada, Nobuhiro Yuki, Brain Gangliosides in Alzheimer's Disease: Increased Expression of Cholinergic Neuron-Specific Gangliosides, Curr. Alzheimer Res. 2017, 14, 586.
8. G L Lenzi, F Grigoletto, M Gent, R S Roberts, M D Walker, J D Easton, A Carolei, F C Dorsey, W A Rocca, and R Bruno, Early Treatment of Stroke with Monosialoganglioside GM-1. Efficacy and Safety Results of the Early Stroke Trial, Stroke, 1994, 25, 1552.
9. Kunio Kawanishi, Chirag Dhar, Raymond Do, Nissi Varki, Philip L S M Gordts, Ajit Varki, Human Species-specific Loss of CMP- N-acetylneuraminic Acid Hydroxylase Enhances Atherosclerosis via Intrinsic and Extrinsic Mechanisms, Proc. Natl. Acad. Sci. USA 2019, 116, 16036.
10. Wen-Shan LI, Jhih-Liang Huang, Hsiu-Ting Lin, Shih-Chieh Su, Han-Chung Wu, Lipids, nanoparticles comprising the same and uses thereof, WO 2023/239836 A9, 2023.









 首頁
首頁