【專欄】抗體藥物的發展與應用

抗體的發現與生物功能
人體的免疫系統能夠有效抵禦病原體入侵和清除癌細胞。其中,B細胞在接受到抗原(Antigen)刺激後能夠產生一種蛋白質稱為「抗體 (Antibody)」。抗體能夠精準地辨識並結合特定病原體或抗原,協助人體抵禦感染、調節免疫反應,以及幫助其他細胞清除外來物質。抗體最初是在19世紀末由德國科學家Emil von Behring和日本科學家北里柴三郎所發現。兩位科學家的重大發現接著發展出對抗白喉 (Diphtheria)與破傷風 (Tetanus)毒素的抗血清,造福無數人免於當時束手無策的疾病。這項研究獲頒1901年第一屆諾貝爾生醫獎,不僅幫助人們更好地理解免疫系統如何抵抗疾病,同時開啟抗體研究的顯學時代。
抗體技術的開發
抗血清的發現讓抗體的應用可能性浮上檯面。要能產出可應用的抗體,必須先有開發抗體的技術。歷史上兩項重大抗體開發技術突破,第一是雜交瘤技術 (Hybridoma),由Georges J.F. Köhler 和César Milstein於1975年發明,允許大量生產單一類型的抗體。第二項突破是噬菌體呈現技術 (Phage display),由George P. Smith 和Sir Gregory P. Winter於1980年代開發。該技術將抗體基因植入噬菌體,篩選出能有效結合目標的抗體。雜交瘤技術可以獲得龐大的抗體多樣性,但開發過程耗時。噬菌體呈現技術可以在一個月內篩選出抗體,但是抗體多樣性較低。這兩項技術共同推動了抗體藥物的發展,為治療癌症、自體免疫疾病和傳染病提供強大工具。它們分別於1984年和2018年獲得諾貝爾獎的認可,凸顯其在生物醫學領域的重要性。
抗體的科學應用和臨床診斷
在科學實驗中,抗體可以用來檢測特定蛋白質,例如透過西方墨點法 (Western Blot)、流式細胞儀(Flow cytometry)、免疫螢光染色 (Immunofluorescence)或酵素結合免疫吸附分析法 (Enzyme-linked immunosorbent assay, ELISA)等方法;而利用抗體的高靈敏度與特異性,在臨床診斷則能準確且快速地偵測疾病相關蛋白質的存在與濃度變化,例如攝護腺癌的攝護腺特定抗原 (Prostate-specific antigen, PSA)、肝癌的甲型胚胎抗原 (alpha-fetoprotein, AFP)新型冠狀病毒 (SARS-CoV-2)和A/B型流行性感冒 (Influenza A/B)的快篩或過敏原偵測等。
抗體藥物的發展
抗體最為人所愛戴的應用勢必為抗體藥物。其特性是能更準確地作用於特定目標,降低對健康細胞的副作用。抗體藥物在近25年的銷售量急遽抬升,打破傳統小分子藥物霸佔的藥物市場。2000年初期全球市場藥物銷售前10名以小分子藥物為主;而在2024年前10名藥物則是有7個是抗體藥物 (圖一),顯示出抗體藥物在臨床應用越加廣泛且對於病患的治療效果比小分子藥物更為顯著。以去年(2024)銷售最好的Keytruda® (Pembrolizumab)為例:此抗體目標蛋白為T細胞上的PD-1,用於阻斷PD-1與癌細胞上的PD-L1 結合,減少T細胞不活化訊號,使T細胞免於進入耗竭 (exhaustion)狀態。Keytruda®三期臨床試驗結果顯示在PD-L1表現的非小細胞肺癌 (non-small cell lung cancer, NSCLC)病患上與傳統治療相比有顯著進步:中位數疾病無惡化存活期(Median progression-free survival, mPFS)為10.3個月,化療組別為6.0個月;而6個月預期存活期(Overall survival, OS)在Keytuda®組別為80.2%,化療組別則為72.4%。除了癌症以外,治療類風濕性關節炎的Humira® (Adalimumab)針對名為TNF-α的細胞激素做結合,降低自體免疫患者體內的發炎反應,進而減少自體免疫病症的發生。臨床三期試驗結果和傳統療法比較亦明顯提升患者的治療效果和生活品質。
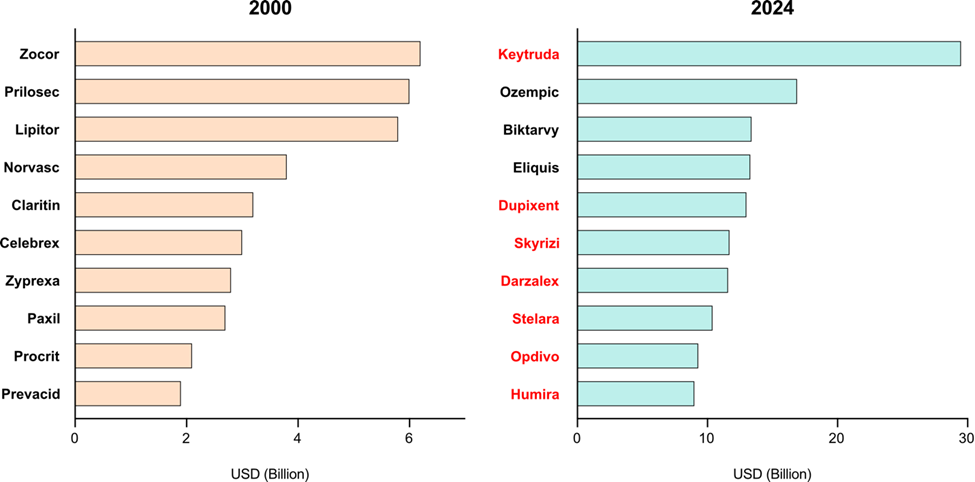
圖一、2000年與2024年當年度全球銷售前10名藥物。左圖為2000年,右圖為2024年。紅字為抗體藥物。
抗體藥物的革新和臨床應用
近年來,抗體藥物不斷推陳出新,例如人源化 (Humanize)抗體、雙特異性 (Bispecific)抗體、抗體藥物偶聯物 (Antibody-drug conjugate, ADC)和利用抗體單鏈變異區片段 (Single-chain variable fragment, scFv)做出的嵌合抗原受體T細胞 (Chimeric antigen receptor T cells, CAR-T) (圖二)。
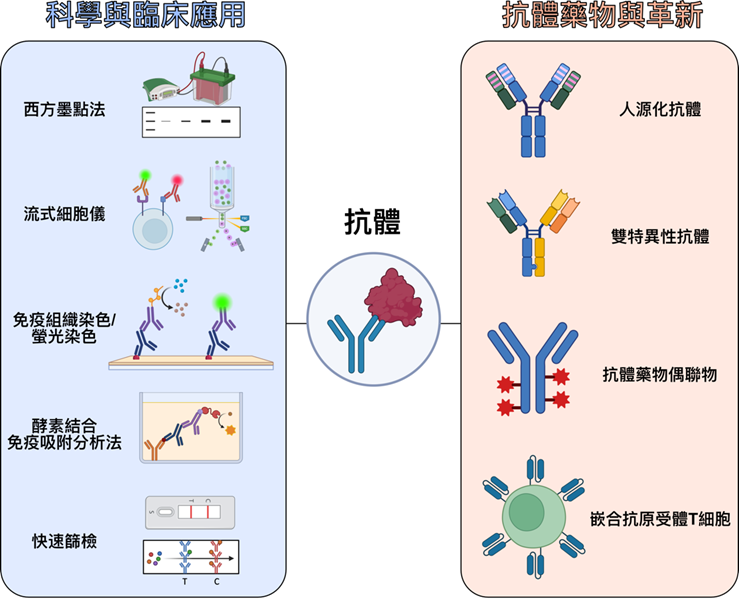
圖二、抗體的應用與多面向發展。左側為抗體在科學實驗和臨床診斷的用途。右側為抗體作為藥物和治療方針時的應用。
人源化抗體是將藉由其他生物體產出的抗體(如實驗鼠)進行編輯,使其更適合人體。目前美國食品藥物管理局 (Food and Drug Administration, FDA)核可的抗體藥物中多數都為人源化抗體,包括標的乳癌HER2的Herceptin® (Transtuzumab)、標的肝細胞癌VEGF的Avastin® (Bevacizumab)、標的T細胞PD-1的Keytruda® (Pembrolizumab)和標的癌細胞PD-L1的Tecentriq® (Atezolizumab)等知名臨床用藥。
雙特異性抗體為近年新興抗體藥物,其特色在於可同時標的兩個目標蛋白,增強療效也降低脫靶效應 (off-target effect)。Blincyto® (Blinatumomab)為2014年首度被核可使用的雙特異性抗體,可同時標的T細胞CD3和B細胞CD19並用於治療復發或難治型急性淋巴母細胞白血病 (Relapsed or refractory acute lymphoblastic leukemia, R/R ALL)。今年(2025)有一支雙特異性抗體Ivonescimab臨床三期試驗表現亮眼,其同時標的PD-L1和VEGF的臨床治療效果(mPFS 11.1個月)與僅以Keytruda® (Pembrolizumab)治療相比 (mPFS 5.8個月)有顯著提升。
抗體藥物偶聯物(ADC)則是藉由抗體專一性特性,在抗體尾端接上具有毒性的藥物,使得藥物能夠精準導向目標。臨床上很常將ADC作為後線治療選擇,其效果雖好,但同時比單純抗體藥物帶有更高的毒性風險。最先被核准使用於臨床上的ADC為Mylotarg® (Gemtuzumab ozogamicin),以CD33為標的帶有卡奇黴素 (Calicheamicin)用於治療CD33+急性骨髓性白血病(Acute myeloid leukemia, AML)。現行臨床上最具代表性的ADC非Enhertu ® (Trastuzumab deruxtecan)莫屬,由阿斯特捷利康 (AstraZeneca, AZ)和第一三共 (Daiichi Sankyo)共同研發並使用在已經過兩次以上anti-HER2治療的HER2+ 無法切除或轉移性乳癌(Unresectable or metastatic breast cancer)病人。此ADC特點在於利用標的HER2的抗體Trastuzumab帶有第一型拓樸異構酶抑制劑(Topoisomerase I inhibitor) Deruxtecan 用以干擾癌細胞DNA複製與細胞分裂。在三期臨床試驗中,Enhertu®組別與醫師抉擇治療組(Physician’s choice)的病人相比,可以將mPFS由5.4個月延長至10.1個月;mOS則可以由17.5個月延長至23.9個月。今年(2025)1月阿斯特捷利康和第一三共有另一支ADC,Datroway® (datopotamab deruxtecan),亦被美國FDA核可使用於治療HR+HER2-乳癌病人,為乳癌病人增添一大福音。
嵌合抗原受體T細胞 (Chimeric antigen receptor T cells, CAR-T)是改造抗體藥物使其應用於細胞治療上。CAR-T已經成功應用在治療淋巴瘤(Lymphoma)與白血病(Leukemia),針對B細胞表面的抗原如CD19或BCMA。時至今日,美國FDA已核可四種CD19 CAR-T (Kymriah®、Yescarta®、Tecartus®和Breyanzi®),以及兩種BCMA CAR-T (Abecma® 和 Carvykti®)。CAR-T中最早由Kymriah®獲得臨床應用許可,在治療B細胞急性淋巴母細胞性白血病(B-ALL)後3個月內的客觀緩解率(Objective response rate, ORR)達81%, 6個月後的OS更高達90%。目前台灣多家醫學中心已經開始使用CAR-T,包含台大醫院、台北榮總、中國醫附醫、花蓮慈濟、三軍總醫院等。以全國最早通過可執行CAR-T常規治療的台大醫院為例,在2022年接受第一位10歲女童作為CD19 CAR-T治療,已完全康復。成人首例「癌細胞清零」則是在三軍總醫院完成,此案例為三總與宇越生技公司合力完成,用以評估國產CD19 CAR-T Welgenaleucel (UWC19)安全性與耐受性。
抗體藥物的挑戰與未來發展
雖然抗體從發現到應用已經超過100年,但抗體藥物的未來仍會遇到許多挑戰。首先,抗體的生產成本很高,導致價格相對化學合成藥物昂貴許多。此外,抗體通常需要低溫儲存與特殊運輸條件,增加了物流上的困難。最後,針對腫瘤內部複雜的微環境(microenvironment)也可能影響抗體的療效。未來的研究重點將集中於降低抗體生產成本、研發更便利的給藥方式,例如口服或吸入方式,以提升抗體藥物的使用率。最後則是需要更多研究解析抗體藥物對癌症及其他疾病的治療效果。
除了上述傳統研究以外,隨著人工智慧 (Artificial Intelligence, AI)的發展,AI在抗體發展領域扮演著日益重要的角色。David Baker教授領導華盛頓大學蛋白質設計研究所運用生成式AI技術,成功從零設計出全新抗體。這些AI設計的抗體能精確結合目標蛋白,如流感或新冠病毒的表面病毒蛋白。透過分析大量數據並進行蛋白質結構模擬,AI幫助科學家快速篩選和最佳化抗體序列,大幅縮短傳統方法所需的時間與成本。此開創性研究不僅展示AI在生物醫學領域的巨大潛力,也為新型藥物和疫苗發展開拓出嶄新的道路,進一步造福人類健康。
延伸閱讀
1. Reck, M., Rodríguez-Abreu, D., Robinson, A. G., Hui, R., Csőszi, T., Fülöp, A., Gottfried, M., Peled, N., Tafreshi, A., Cuffe, S., O'Brien, M., Rao, S., Hotta, K., Leiby, M. A., Lubiniecki, G. M., Shentu, Y., Rangwala, R., Brahmer, J. R., & KEYNOTE-024 Investigators (2016). Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. The New England journal of medicine, 375(19), 1823–1833.
2. Xiong, A., Wang, L., Chen, J., Wu, L., Liu, B., Yao, J., Zhong, H., Li, J., Cheng, Y., Sun, Y., Ge, H., Yao, J., Shi, Q., Zhou, M., Chen, B., Han, Z., Wang, J., Bu, Q., Zhao, Y., Chen, J., … Zhou, C. (2025). Ivonescimab versus pembrolizumab for PD-L1-positive non-small cell lung cancer (HARMONi-2): a randomised, double-blind, phase 3 study in China. Lancet (London, England), 405(10481), 839–849.
3. Modi, S., Jacot, W., Yamashita, T., Sohn, J., Vidal, M., Tokunaga, E., Tsurutani, J., Ueno, N. T., Prat, A., Chae, Y. S., Lee, K. S., Niikura, N., Park, Y. H., Xu, B., Wang, X., Gil-Gil, M., Li, W., Pierga, J. Y., Im, S. A., Moore, H. C. F., … DESTINY-Breast04 Trial Investigators (2022). Trastuzumab Deruxtecan in Previously Treated HER2-Low Advanced Breast Cancer. The New England journal of medicine, 387(1), 9–20.









 首頁
首頁